概要|研究内容|詳細3:ノンコーディングRNA(マイクロRNA等)の機能解析と核酸医薬開発への応用
マイクロRNA (miRNA)は内在性の約22塩基の小さなnon-coding RNAであり、標的mRNAに存在する部分的相補配列に結合し発現を抑制する。ヒトからは1000以上のmiRNAが単離されており、またそれぞれのmiRNAが複数の標的遺伝子の発現を制御していることから、細胞のなかでは我々の想像を遥かに超える遺伝子制御ネットワークが働いている。現在、miRNAは発生、分化、細胞増殖、アポトーシス等の広範な生命機能に関わっていることが次々と報告されており(図7)、今後、ますますその重要性は大きくなっていくものと予想される。

図7. マイクロRNAとは?
当研究室では、以下のような課題に取り組んでいます。
(1) 癌や血管新生に関与するmiRNAの機能解析と治療・診断への応用(図8)
(2) miRNAの遺伝子発現制御系を付与したベクターの開発(図9, 10)
(3) 特定のmiRNAの機能を欠損させたノックアウトマウスの作製とその機能(表現型)解析
(4) RNA induced silencing complexの主要因子であるArgonaute2の機能解析
(5) 転写レベルで遺伝子発現が上昇する現象であるRNA activationに関する研究
(6) 効果的なRNAi誘導法の開発
(7) アデノウイルス由来小分子RNA(VA-RNA)の機能解析 等
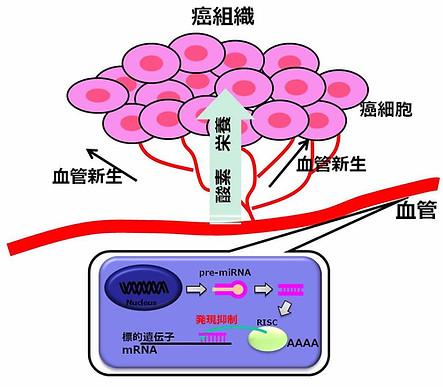

図8. miRNAを介した血管新生制御
癌組織は、増殖に向けて酸素や栄養を得るため、既存の血管から癌組織に向けて新たな血管網を構築しようとする(血管新生)。その際に、血管を構成する血管内皮細胞では、血管網の構築に向けて様々な遺伝子発現制御が行われており、miRNAもその発現制御に向けて重要な役割を果たしていると考えられる。
図9. miRNAによる遺伝子発現制御機構を搭載したアデノウイルスベクター
導入遺伝子の3' 非翻訳領域に、miRNAの標的配列を挿入することで、転写が起こっても、miRNAが標的配列に結合することでmRNAの分解が誘導され、翻訳が抑制される。すなわち、導入遺伝子が発現してほしくない臓器で高発現しているmiRNAの標的配列を挿入することで、その臓器における導入遺伝子の発現を抑制することができる。上の図では、肝臓特異的miRNAであるmiR-122aの標的配列を挿入することで、肝臓における導入遺伝子の発現を抑制している。

図10. miRNAによる遺伝子発現制御機構を搭載した制限増殖型アデノウイルス
制限増殖型アデノウイルスの正常細胞における複製は、腫瘍特異的プロモーターを使用することで(上記図ではhTERTプロモーター)抑制されている。しかし、わずかながらウイルスが増殖することによる副作用の危険性がある。そこで、正常細胞特異的に高発現しているmiRNAの標的配列を、アデノウイルスの自己増殖に必須の遺伝子であるE1遺伝子の3' 非翻訳領域に挿入することで、癌細胞における増殖を維持したまま、正常細胞における増殖を大きく抑制することが可能となる。
最近の主な成果
Bennett D, et al., Further reduction in adenovirus vector-mediated liver transduction without largely affecting transgene expression in target organ by exploiting microRNA-mediated regulation and the Cre-loxP recombination system. Mol. Pharm., in press.
Sakurai F, et al., Suppression of hepatitis C virus replicon by adenovirus vector-mediated expression of tough decoy RNA against miR-122a. Virus Res., 165, 214-218 (2012)
Motegi Y, et al., An effective gene-knockdown using multiple shRNA-expressing adenovirus vectors. J. Cont. Rel., 153, 149-153 (2011)
Sugio K., et al., Enhanced safety profiles of the telomerase-specific replication-competent adenovirus by incorporation of normal cell-specific microRNA-targeted sequences. Clin. Cancer Res., 17, 2807-2818 (2011)
Furukawa N., et al., Optimization of a microRNA expression vector for function analysis of microRNA. J. Cont. Rel., 150, 94-101 (2011)
Yamaguchi T, et al., Induction of type I interferon by adenovirus-encoded small RNAs. Proc. Natl. Acad. Sci. USA., 107, 17286-17291 (2010)
Suzuki T, et al., miR-122a-regulated expression of a suicide gene prevents hepatotoxicity without altering antitumor effects in suicide gene therapy. Mol. Ther., 16, 1719-1726 (2008)
